北理工课题组揭示细胞应激压力下自噬调控与溶酶体稳态机制研究新进展

应激压力通过激活自噬增强细胞内循环,实现蛋白质平衡与细胞器质量控制来维持细胞稳态。解析自噬激活途径中必经的溶酶体稳态机制对理解肿瘤细胞如何应对额外应激压力(如靶向药物)和寻找新的干预靶点至关重要。近日,北京成品人和一品二品的区别生命学院董磊教授与夏琴特别副研究员团队,在国际知名 SCI 期刊《Advanced Science》发表题为 “Gal3-CaN-Smurf1 complex sequestrates FLCN-FNIPs to facilitate TFEB activation in response to endomembrane damage” 的研究成果。该研究报道:致癌蛋白 E3 泛素连接酶 Smurf1 能够感知溶酶体破损产生的应激信号,并将其传递至细胞生长调控中枢 mTOR,通过抑制 mTOR 生长信号,进一步激活自噬转录因子 TFEB,最终促进受损溶酶体的清除与新溶酶体的生成。同时,研究还揭示了 Gal3-CaN-Smurf1 复合体与 FLCN-FNIPs 复合体通过协同作用,调控 TFEB 定位与活性的关键分子机制。
转录因子 EB(TFEB)是调控溶酶体生物合成与自噬降解过程的核心分子,其通过 “磷酸化与去磷酸化” 双向调控机制维持细胞稳态平衡。此前研究已证实两大关键调控通路:一是受损溶酶体释放的 Ca²⁺可激活钙调磷酸酶,进而诱导 TFEB 入核,该通路被认为是饥饿应激与溶酶体损伤下 TFEB 激活的共有途径;二是 mTORC1 可通过磷酸化 TFEB 的 S211 位点,促使其与 14-3-3 蛋白结合并滞留于细胞质,从而抑制 TFEB 活性。而在溶酶体损伤状态下,细胞可通过 Rag GTP 酶依赖性途径,选择性解除 mTORC1 对 TFEB 的磷酸化抑制。其中,FLCN 作为 RagC/D 的激活因子,能凭借 GAP 活性推动 Rag-Ragulator 复合体从非活性态向活性态转换,若 FLCN 功能缺失,会特异性阻断 mTOR 介导的 TFEB 磷酸化,导致 TFEB 过度活化。
基于上述研究基础,团队进一步明确:Smurf1 介导的 TFEB 核易位过程,需依赖 RagC 失活及 RagC 与 TFEB 的解离。通过剖析 Gal3-CaN-Smurf1介导的FLCN-FNIPs隔离机制,以及内膜损伤响应中 TFEB 激活的分子互作与结构基础,研究最终阐明 Smurf1 在溶酶体损伤响应中的核心调控作用(图 1):当溶酶体发生损伤时,Gal3-CaN-Smurf1 复合体通过 “双重机制” 激活 TFEB。
1.信号通路阻断:Smurf1 通过介导 RagC-TFEB 解离、隔离 FLCN-FNIPs 二聚体,破坏 mTORC1 对 TFEB 的特异性磷酸化,解除其活性抑制;
2.分子修饰调控:Smurf1 可直接泛素化 TFEB,促进其去磷酸化,加速 TFEB 激活。
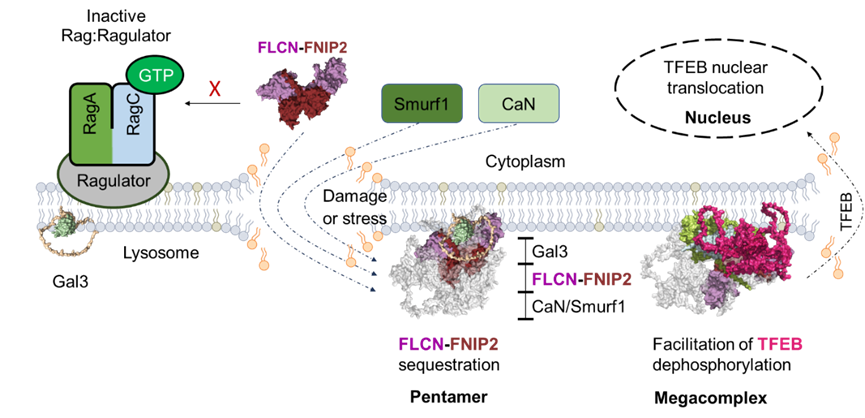
图 1 Gal3-CaN-Smurf1复合物的募集在损伤后维持溶酶体膜稳态中的作用示意图
研究还发现,FLCN 的 K462 位点与 FNIP2 的 K466 位点发生多聚泛素化,是维持 Gal3-CaN-Smurf1-FLCN-FNIP2 五聚体稳定性的关键;若上述位点发生突变(K462R/K466R),会显著削弱该复合体的形成能力。综上,该研究证实 FLCN-FNIPs 与 Gal3-CaN-Smurf1 复合体通过协同互作,实现对溶酶体损伤信号的响应及 TFEB 定位与活性的精准调控,为进一步解析 TFEB 调控网络、探索其在肿瘤适应性过程中的潜在治疗价值提供了全新视角。